某溶液中含有HCO3-、SO32-、CH3COO-、CO32-四种离子,若向其中加入Na2O2后,溶液
中离子浓度基本保持不变的是
| A.HCO3- | B.SO32- | C.CH3COO- | D.CO32- |
利用下图装置进行实验(必要时可加热),不能得出相应结论的是
| |
溶液① |
固体② |
溶液③ |
实验结论 |
 |
| A |
稀硫酸 |
Na2CO3 |
Na2SiO3 |
非金属性:C>Si |
|
| B |
浓盐酸 |
MnO2 |
Na2S |
氧化性:Cl2>S |
|
| C |
盐酸 |
CaCO3 |
C6H5ONa |
酸性:碳酸>苯酚 |
|
| D |
稀硫酸 |
Na2CO3 |
CaCl2 |
CO2不与氯化钙反应 |
在一定条件下,下列微粒的还原性顺序为Cl-<Br-<Fe2+<I-<SO2,由此判断以下各反应在溶液中不能发生的是
| A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| B.2Fe2++Cl2=2Fe3++2Cl- |
| C.2Br-+4H++SO42-=SO2+Br2+2H2O |
| D.I2+SO2+2H2O=4H++SO42-+2I- |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
将NaOH溶液滴入该溶液中加热,放出的气体能使湿润的红色石蕊试纸变蓝 |
证明溶液中有NH4+ |
| B |
向某溶液中加入稀盐酸,放出无色刺激性气味气体,将气体通入澄清石灰水,石灰水变浑浊 |
证明该溶液中存在SO32- |
| C |
将Cl2通入品红溶液中,品红溶液褪色 |
证明Cl2的还原性 |
| D |
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
证明氧化性:H2O2比Fe3+强 |
铜、铁、锌等质量合成的合金W g,加入FeCl3和盐酸的混合液中,充分反应后: (1)若无固体剩余,则溶液中的阳离子一定有 ,还可能有 。
(2)若剩余固体为W/3 g,则溶液中的阳离子一定有 ,可能还有 。一定没有 。
(3)若剩余固体为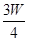 g,则溶液中的阳离子一定有 ,一定没有 .
g,则溶液中的阳离子一定有 ,一定没有 .
常温时,下列三个反应都能向右进行:
2W +X
+X
 2X
2X +W
+W
2Y +W
+W
 2W
2W +Y
+Y
2X +Z
+Z
 2Z
2Z +X
+X
由此得出的正确结论是( )
A.X 、Y 、Y 、Z 、Z 、W 、W 中Z 中Z 的还原性最强 的还原性最强 |
B.X 、Y 、Y 、Z 、Z 、W 、W 中Z 中Z 的氧化性最弱 的氧化性最弱 |
C.2Z +Y +Y  2Y 2Y +Z +Z 不能向右进行 不能向右进行 |
D.还原性X >Y >Y |
下述实验不能达到预期目的的是
| 选项 |
实验目的 |
实验方案 |
| A |
验证Ksp(AgCl)>Ksp(AgI) |
向NaCl溶液中滴加少量AgNO3溶液,产生白色沉淀,再滴加KI溶液,可观察到白色沉淀转化为黄色沉淀 |
| B |
检验Fe(NO3)2晶体是否已氧化变质 |
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C |
验证Br2的氧化性强于I2 |
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色 |
| D |
比较确定铜和镁的金属活动性强弱 |
用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
I(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是 。
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程是 。
(3)对比(1)和(2)实验所得的结果,将Cl 、I
、I SO2按还原性由强到弱顺序排列为 。
SO2按还原性由强到弱顺序排列为 。
II .(4) 除去铁粉中混有铝粉的试剂是 ,离子方程式为
(5) 1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3C  2AlN + 3CO下列叙述正确的是
2AlN + 3CO下列叙述正确的是
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 |
| B.上述反应中每生成2molAlN,N失去6mol电子 |
| C.氮化铝中氮元素的化合价为-3 |
| D.氮化铝的摩尔质量为41g/mol |
在KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)中,下列说法错误的是
| A.HCl体现酸性和还原性 |
| B.生成1mol Cl2时,转移10mol电子 |
| C.HCl部分被氧化,被氧化HCl占参加反应HCl的5/8 |
| D.上述方程式说明还原性:KMnO4>Cl2 |
在酸性条件下:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原成Br2;
②KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原成I2。
(1)上述反应所涉及到的粒子氧化性最强的是 (填离子符号);
(2)写出一个能证明氧化性Br2>I2的离子方程式 ;
(3)向含有KI、H2SO4的溶液中加入KBrO3溶液,若氧化产物、还原产物只有I2和Br2,写出反应的化学方程式,并标明电子转移方向和数目。
_______________________________________________________;
其中被氧化的元素是_________,要得到1mol还原产物转移电子数目为____________。
在常温下,发生下列几种反应:
①16H++10Z-+2XO4-=2X2++5Z2+8H2O
②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z-
根据上述反应,判断下列结论中错误的是
| A.溶液中可发生:Z2 + 2A2+ = 2A3+ + 2Z- | B.Z2在①、③反应中为还原剂 |
| C.氧化性强弱的顺序为:XO4 - > Z2 > B2 > A3+ | D.X2十是XO4-的还原产物[ |
常温下,在下列溶液中发生如下反应:
①16H++10Z-+2XO4-==2X2++5Z2+8H2O ②2A2++B2==2A3++2B-
③2B-+Z2==B2+2Z- 由此判断下列说法正确的是( )
| A.反应Z2+2A2+==2A3++2Z-不能进行 |
| B.Z元素在①③反应中均被氧化 |
| C.还原性由强到弱的顺序是A2+、B-、Z-、X2+ |
| D.氧化性由弱到强的顺序是XO4-、Z2、B2、A3+ |
氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl﹣<Br﹣<CN﹣<SCN﹣<I﹣.
试写出:
(1)(CN)2与KOH(aq)反应的化学方程式: ;
(2)NaBr和KSCN的混合溶液中加入足量(CN)2反应的离子方程式: .
试题篮
()