常温下,向0.25 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是
| A.硫酸溶液的体积为30 mL |
| B.b时刻溶液中SO42-的浓度约为0.125 mol·L-1 |
| C.d时刻溶液的pH约为13 |
| D.溶液的导电能力:c<d=b<a |
亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的 ( )
| A.1molL-1亚硝酸溶液的c(H+)约为1×10-2mol·L-1 |
| B.亚硝酸能与水以任何比例互溶 |
| C.10mL、1mol·L-1亚硝酸恰好与10mL、1mol·L-1NaOH溶液完全反应 |
| D.亚硝酸溶液的导电性比强酸溶液的弱 |
下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中: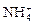 、 、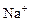 、 、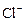 、I― 、I― |
| B.常温下,pH=12的溶液中:SO32―、Cl―、K+、SiO32- |
C.在pH=1的溶液中: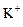 、 、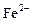 、 、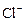 、 、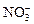 |
D.在无色透明溶液中: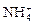 、 、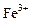 、 、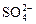 、 、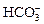 |
已知0.1mol/L的二元酸H2A溶液的pH=4,则下列说法中不正确的是 ( )
A.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
B.在Na2A溶液中一定有:c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.在Na2A和NaHA的两种溶液中离子种类相同
D.在溶质物质的量浓度相等的Na2A和NaHA溶液中,阴离子总数相等
常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中得一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。下列说法中不正确的是: ( )
A.D溶液的pH=7
B.四种溶液相比,C溶液中水的电离程度最大
C.A与C等体积混合后,溶液中有c(Cl-)>c(NH4+) >c(H+) >c(OH-)
D.B与D等体积混合后,溶液中有c(OH-)=c(CH3COOH)+c(H+)
常温时,有浓度均为0.1 mol/L的四种溶液:①Na2CO3溶液②NaHCO3溶液③盐酸④氨水,下列有关说法不正确的是( )
| A.上述溶液中,既能与NaOH反应,又能与H2SO4反应的溶液中离子浓度由大到小的顺序为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| B.向④中加入少量的NH4Cl固体,此时溶液中c(NH4+)/c(OH-)的值增大 |
| C.若将③和④的溶液混合后,溶液恰好呈中性,则混合前溶液的体积为③<④ |
| D.取10 mL溶液③,加水稀释到100 mL,此时溶液中由水电离的c(H+) = 1×10-12mol/L |
有关电解质的下列叙述正确的是 ( )
| A.离子化合物熔融状态时都导电,因此离子化合物都是电解质 |
| B.共价化合物熔融状态时都不导电,因此共价化合物都是非电解质 |
| C.易溶于水的化合物都是强电解质 |
| D.强电解质溶液的导电能力一定强 |
下列说法中不正确的是 ( )
| A.将纯水加热至较高温度,水的离子积变大,pH变小,呈中性 |
| B.氨水和盐酸混合后溶液呈酸性,溶液中离子浓度大小关系一定存在:c(NH4+)>c(H+) |
| C.相同温度下,pH=2的醋酸溶液与pH=2的盐酸中c(H+)之比为1:l |
| D.向盛有少量Mg(OH)2沉淀的试管中加入NH4Cl浓溶液,振荡,沉淀会逐渐溶解 |
下列说法正确的是
| A.KClO3和SO3溶于水后均能导电,故KClO3和SO3都是电解质 |
| B.常温下将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.常温下,等浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
| D.25℃时,用pH=3的盐酸滴定等浓度的氨水至溶液的pH=7,V(氨水)<V(盐酸) |
下图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3 K 时开始分解为无水硫酸钠。现有142 g温度为T2 K的饱和硫酸钠溶液,当温度降为T1 K或升为T4 K(T4>T3)时析出晶体的质量相等,则温度为T4 K时Na2SO4的溶解度为
| A.小于40g | B.等于40g | C.等于42g | D.大于42g |
将1mol·L-1H2SO4溶液100mL与质量分数为10%的NaOH溶液50g混合均匀后,滴入甲基橙指示剂,此时溶液的颜色是
| A.浅紫色 | B.黄色 | C.红色 | D.无色 |
下列化学原理表述正确的是
| A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大; |
| B.Na2CO3溶液中满足:c(Na+)=2c( CO32-)+2 c( HCO3-)+ 2c (H2CO3) |
C.NaHCO3溶液不显中性的原因:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多; |
将等浓度的K2S溶液和NaHSO4溶液等体积混合,得到的溶液中离子浓度关系正确的是
A.c(K+)>c(Na+)>c(H+)>c(OH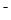 ) ) |
B.c(Na+)+c(K+)+c(H+)=c(SO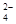 )+c(HS )+c(HS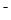 )+c(OH )+c(OH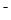 )+c(S2一) )+c(S2一) |
C.c(SO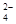 )>c(HS )>c(HS )>c(OH )>c(OH )>c(H+) )>c(H+) |
D.c(K+)=c(S2一)+c(H2S)+c(HS )+c(SO )+c(SO ) ) |
下列关于电解质溶液的叙述正确的是 ( )
A.常温下,Ph=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为:   |
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
C.室温下,CH3COOH分子可存在于pH=8的碱性溶液中 |
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
试题篮
()