在化工生产中,常用MnS(s)作沉淀剂处理含Cu2+的废水。其反应原理为:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是
| A.该反应达到平衡时:c(Cu2+)=c(Mn2+) |
| B.CuS的溶解度比MnS的溶解度小 |
| C.往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大 |
D.该反应平衡常数表达式: |
一定温度下,难溶强电解质的饱和溶液中存在着沉淀溶解平衡,其平衡常数为
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp(25℃) |
8.0×10﹣16 |
2.2×10﹣20 |
4.0×10﹣38 |
对于含Fe2(SO4)3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,说法错误的是
A.向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.向溶液中加入双氧水,并用CuO粉末调节pH,过滤后可获较纯净的CuSO4溶液
C.该溶液中c(SO42﹣):[c(Fe3+)+c(Fe2+)+c(Cu2+)]=5:4
D.将少量FeCl3粉末加入含Cu(OH) 2的悬浊液中,其中c(Cu2+)增大
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
Cl2有酸性 |
用Cl2可与石灰乳或烧碱反应制备含氯消毒剂 |
| B |
NaHCO3溶于水完全电离 |
NaHCO3是强电解质 |
| C |
浓H2SO4有强氧化性 |
浓H2SO4可用于干燥SO2 |
| D |
Na2S有强还原性 |
用于除去废水中的Cu2+和Hg2+ |
常温下,AgCl、AgBr、AgI的溶度积常数(Ksp)依次为1.8×10-10、5.4×10-13、8.5×10-17,下列说法错误的是
| A.常温下在水中的溶解能力AgCl>AgBr>AgI |
| B.在AgCl饱和溶液中加入饱和NaBr溶液有AgBr沉淀生成 |
| C.在AgI饱和溶液中加入饱和NaCl溶液有AgCl沉淀生成 |
| D.将AgCl、AgBr和AgI的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,生成的AgI沉淀最多 |
已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18;CuS:Ksp=6.3×10-36。下列说法正确的是
| A.同温度下,CuS的溶解度大于FeS的溶解度 |
| B.同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小 |
| C.向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS |
| D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是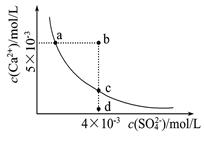
| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp等于c点对应的Ksp |
| C.向d点溶液中加入适量CaCl2固体可以变到c点 |
| D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L |
化学中常借助曲线图来表示某种变化过程,如图:下列曲线图中从左到右依次表示上述过程中的
①平衡移动过程 ②中和滴定过程
③沉淀的生成和溶解 ④固体物质的溶解度变化过程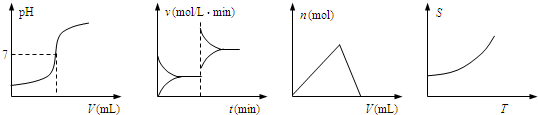
| A.①②③④ | B.②③①④ | C.④③②① | D.②①③④ |
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 |
Cu(OH)2 |
Fe (OH)2 |
Fe (OH)3 |
| 开始沉淀pH |
4.2 |
5.8 |
1.2 |
| 完全沉淀pH |
6.7 |
8.3 |
3.2 |
则在pH=4的溶液中能够大量共存的离子组是
A.Fe 3+、Cu2+、Cl-、NO3- B.Fe 2+、K+、SO42-、NO3-
C.Cu2+、Na+、CO32-、SO42- D.Fe 2+、K+、SO42-、Cl-
向 溶液中加入过量难溶电解质
溶液中加入过量难溶电解质 ,可使溶液中含有的
,可使溶液中含有的 、
、 、
、 等金属离子转化为硫化物沉淀,从而得到纯净的
等金属离子转化为硫化物沉淀,从而得到纯净的 。下列分析正确的是
。下列分析正确的是
A. 具有吸附性 具有吸附性 |
B. 有还原性,将 有还原性,将 还原后除去 还原后除去 |
C. 溶液度大于 溶液度大于 、 、 、 、 |
D. 与 与 反应的离子方程式是 反应的离子方程式是 |
下列叙述和推论都正确的是
| |
叙述 |
推论 |
| A |
酸性:HCl >H2CO3>H2SiO3 |
非金属性:Cl >C>Si |
| B |
组成原电池时,通常是还原性较强的物质做负极 |
镁和铝在氢氧化钠溶液中组成原电池时,镁做负极 |
| C |
—OH是亲水基,含有—OH的有机物都易溶于水 |
常温时,C2H5OH和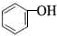 都易溶于水 都易溶于水 |
| D |
溶解度小的沉淀可转化成溶解 度更小的沉淀 |
向AgCl悬浊液中滴加KI溶液可以得到AgI沉淀 |
已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4(s) 2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如下图所示,则下列说法错误的是
2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如下图所示,则下列说法错误的是
| A.向该体系中加入饱和NaOH溶液,溶解平衡向右移动 |
| B.向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 |
| C.升高温度,反应速率增大,平衡向正反应方向移动 |
| D.该平衡的Ksp=c(Ca2+) ·c(K+)·c(Mg2+)·c(SO42-) |
某同学为了探究沉淀的溶解平衡原理并测定某温度下PbI2的溶度积常数,设计了如下实验:I、取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌、静置,过滤到洁净的烧杯中,得到滤液a ;II、取少量滤液a于试管中,向其中加入几滴0.1mol/L的KI溶液,观察现象 ; III、另准确量取10.00 mL滤液,与离子交换树脂(RH)发生反应:2RH+Pb2+=R2Pb+2H+,交换完成后,流出液用中和滴定法测得n (H+)=3.000×10—5mol。分析过程,下列说法错误的是
| A.步骤I中搅拌的目的是使碘化铅充分溶解 |
| B.步骤II中观察到的现象是产生黄色沉淀 |
| C.此实验温度下,PbI2的溶度积常数Ksp=1.350×10-8 |
| D.若步骤I 盛装滤液的烧杯中有少量的水,Ksp的测定结果不受影响 |
海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
| 模拟海水中的离子浓度/mol·L-1 |
Na+ |
Mg2+ |
Ca2+ |
Cl- |
HCO3- |
| 0.439 |
0.050 |
0.011 |
0.560 |
0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。
Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6 ,Ksp(Ca(OH)2)=4.68×10-6,Ksp(Mg(OH)2)=5.61×10-12
下列说法不正确的是
A.沉淀物X为CaCO3、MgCO3
B.滤液M中存在Mg2+、Ca2+
C.滤液N中存在Ca2+、没有Mg2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为仍Mg(OH)2,没有Ca(OH)2
下列实验“操作和现象”与“结论”对应关系正确的是
| |
操作和现象 |
结论 |
| A |
处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 |
溶解度: S(CaCO3)<S(CaSO4) |
| B |
用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 |
该电极为阳极 |
| C |
向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 |
氧化性:Cu2+>Fe3+ |
| D |
向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 |
该溶液中一定含有Ag+ |
关于沉淀溶解平衡和溶度积常数,下列说法不正确的是
| A.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) |
| B.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
C.已知25℃时,Ksp[Fe(OH)3]=4.0×10—38,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K=4.0×104 Fe3++3H2O的平衡常数K=4.0×104 |
| D.已知25℃时,Ksp[Mg(OH)2]=1.8×10—11,在MgCl2溶液中加入氨水,测得混合液的pH=11,则溶液中的c(Mg2+)=1.8×10-5mol·L—1 |
试题篮
()