硝酸钾和在不同温度时的溶解度如下表所示。
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
| 溶解度/g |
硝酸钾 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
202 |
246 |
| 硝酸钠 |
73 |
80 |
87 |
95 |
103 |
114 |
125 |
136 |
150 |
163 |
170 |
(1)20℃时,向100g水中加入35g硝酸钾,要使其完全溶解,应溶液温度;
(2)现有80℃的硝酸钠饱和溶液250g,要使其析出晶体70g,应降温至℃;
(3)硝酸钾和硝酸钠在t℃时的溶解度均为W,分析上表可推知,W的数值所在的最小范围是;将溶剂质量相同的硝酸钾和硝酸钠的饱和溶液从t1℃降温至t2℃,前者析出的晶体比后者多,则t1、t2的取值范围正确的是(填字母)。
A.仅0≤t2<t1≤t B.仅t≤t2<t1≤100 C.0≤t2<t1≤100
如图是甲、乙两种固体物质的溶解度曲线.

(1)
时,甲和乙
(2)乙的饱和溶液从
降到
时,乙的溶液为(填"饱和"或"不饱和")溶液.
(3)
时,甲的饱和溶液中溶质的质量分数为(精确到0.1%).
(4)
时,将100g10%的甲溶液加水稀释成溶质质量分数为5%的溶液,应加水g.
溶液在日常生活和工农业生产中具有广泛用途。
(1)碘酒是医院常用的消毒药品,碘酒中的溶剂是。
(2)
和
两种物质的溶解度曲线如图所示。
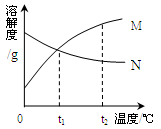
①
时,两物质溶解度由大到小的顺序是。
②两种物质中,的溶解度随温度升高而增大,
时的两种饱和溶液升温到
时仍为饱和溶液的是。
20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有
水的烧杯中,充分搅拌后现象如图1,加热到50℃时,现象如图2,甲、乙两种物质的溶解度曲线如图3,请结合图示回答下列问题

(1)图1中一定为饱和溶液的是。
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为。
(3)图3中表示乙的溶解度曲线是,
点表示的含义是。
下图是
、
、
三种固体物质的溶解度曲线图,请结合图示回答下列问题:

(1)
时,
、
、
三种物质的溶解度大小关系是。
(2)
时,将30g
物质加入到50g水中,充分溶解后,所得溶液是 <填"饱和"或"不饱和">溶液。
(3)室温下,将盛有
的饱和溶液的试管放入盛水的烧杯中,再向烧杯内的水中加入一定量的并
并搅拌,试管内可以观察到的现象是。
(4)将
时
和
的饱和溶液同时升高一定温度后,所得溶液中溶质的质量分数的大小关系是。
下表是氯化钾和硝酸钾在不同温度时的溶解度
| 温度/℃ |
O |
20 |
40 |
60 |
80 |
|
| 溶解度/ | 27.6 |
34.O |
40.0 |
45.5 |
51.1 |
|
| 13.3 |
31.6 |
63.9 |
1lO |
169 |
(1)从表中数据可以看出影响物质溶解度的因素之一是;
(2)根据数据表,在答题卷的图中绘制硝酸钾的溶解度曲线;

(3)从溶解度曲线上查出:45℃时,氯化钾的溶解度为
;
(4)据图分析,要除去硝酸钾中混有的少量氯化钾,可采用的结晶方法是。
溶液在生产和生活中有着重要意义。如图是
三种固体物质的溶解度曲线,请回答下列相关问题:

(1)
℃时,
三种物质的溶解度从大到小的顺序是;
(2)将
℃时
三种物质的饱和溶液升温到
℃,所得溶液中溶质的质量分数最小的是。
下图是甲、乙、丙三种物质的溶解度曲线。

(1)
℃时,甲的溶解度为.
(2) ℃时,甲、乙各50 ,分别加入到100 水中,充分搅拌。其中,不能形成饱和溶液的是.
(3) ℃时,甲的饱和溶液中含有少量的丙,现要提纯甲可采用的方法是.
(4) 下列说法正确的是.
| A. | 将甲、乙的饱和溶液分别从 ℃升温到 ℃,溶质的质量分数都不变 |
| B. | ℃时,向100 20%甲的饱和溶液中加100 水,充分搅拌,溶液的浓度为10% |
| C. | ℃时,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最多的是甲 |
| D. | 升高丙溶液的温度,一定有晶体析出 |
(1)用化学符号表示:
①3个硫原子;
②氧原子的结构示意图;
③2个碳酸根离子。
(2)下图是
、
、
三种不含结晶水的固体物质的溶解度曲线

①物质
的溶解度随温度的升高而。
| A. |
升高 |
B. |
降低 |
C. |
不改变 |
②在的温度范围里,物质
的溶解度大于物质
的溶解度。
③将
、
、
三种物质的饱和溶液,由t1℃升温到t2℃(溶剂量不变),溶液中溶质的质量分数不变的是(选填
、
、
)。
如图是甲、乙两物质的溶解度曲线.
(1)t℃时,甲、乙的溶解度相等 (填“相等”和不“相等”)
(2)45℃时,甲的饱和溶液中溶质和溶剂的质量比为 .
(3)45℃时,将乙的饱和溶液降温至t℃,此过程是否有晶体析出? (填“有”或“没有”)
如图是a、b两种固体物质的溶解度曲线,试回答:
(1)t℃时,两物质的溶解度的大小关系:a_____ b(填“大于”、“等于”或“小于”)
(2)a、b都属于_____物质;(填“难溶”、“微溶”、“可溶”、“易溶”)
(3)在_____℃时a、b的溶解度相等。
(4)20℃时,30克a放入50克水中,所得溶液的质量分数为_____。
下图为氯化钠、碳酸钠在水中的溶解度曲线,请回答下列问题

(1)碳酸钠和氯化钠混合溶液的
7(填"
"或"
"或"
").
(2)
时,碳酸钠的溶解度为
.
(3)大于
时,碳酸钠的溶解度氯化钠的溶解度(填"
"或"
"或"
").
(4)
时,碳酸钠和氯化钠均饱和溶液,当温度降低到
时,析出的主要物质是(填化学式).
(5)为检验(4)中析出的物质,取少量样品于试管中加入足量的(填化学式)溶液,完全溶液,并有气体产生,再加入几滴稀(填化学式)溶液,有白色沉淀产生.
下图是甲、乙两种固体物质的溶解度曲线。
(1) ℃时,甲、乙两种物质的溶解度相等。
(2)t2℃时,将等质量的甲、乙两种物质加水溶解配制成饱和溶液,所得溶液质量的大小关系为:
甲 乙(填“>”、“<”或“=”)。
(3)把乙物质的不饱和溶液变为饱和溶液,下列有关说法正确的是 (填序号)
A.溶质的质量可能不变 B.溶剂的质量一定变小
C.溶质的质量分数一定变大 D.溶液的质量一定变大
(4)通常情况下,在实验室用固体甲配制一定溶质质量分数的甲溶液,需用到的仪器有:托盘天平(带珐码盒)、烧杯和___________(填序号)。
A.酒精灯;B .药匙;C.玻璃棒;D.漏斗;E.铁架台;F.量筒;G 胶头滴管
下图是
、
两种物质的溶解度曲线,根据图示回答下列问题:

(1)
时,
、
两种物质的溶解度是
(填">"、"<"或"=",下同)。
(2)将
的
、
两种物质的饱和溶液各200
,降温至
,析出晶体的质量关系是
。
(3)
时,100
水中溶解50
刚好饱和,那么50
水中溶解
也刚好达饱和,此时溶液的质量分数是(精确到0.1%)。
下图是 、 的溶解度曲线。 时分别将100gA、B的饱和溶液降温至 ,析出固体治理 (填">"、"<"或"=");把 时150gA的饱和溶液稀释为20%,需加水g。

试题篮
()