氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O-2e-→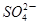 +4H+;(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:
+4H+;(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:
Cl2+2e-→2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为
| A.NaClO | B.ClO2 | C.HClO | D.NaClO4 |
已知:Ni +CuSO4=NiSO4+Cu Cu+2AgNO3=Cu(NO3)2+2Ag 则下列判断正确的是
| A.还原性:Ni>Cu>Ag | B.氧化性:Ni2+ > Cu2+ >Ag+ |
| C.还原性:Ni<Cu<Ag | D.氧化性:Ni2+ < Cu2+ <Ag+ |
对反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4的下列说法正确的是( )
| A.该反应的氧化剂只有CuSO4 |
| B.SO42﹣既不是氧化产物也不是还原产物 |
C.1molCuSO4氧化了 mol的S mol的S |
| D.被还原的S和被氧化的S的质量比为3:7 |
下列叙述中,正确的是( )
| A.含金属元素的离子不一定都是阳离子 |
| B.在氧化还原反应中,非金属单质一定做氧化剂 |
| C.元素从化合态变为游离态时,该元素一定被还原 |
| D.原子失电子数越多还原性越强 |
实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl=NaCl+N2↑+2H2O关于该反应的下列说法正确的是( )
| A.NaNO2是氧化剂 |
| B.N2既是氧化剂,又是还原剂 |
| C.NH4Cl中的氮元素被还原 |
| D.每生成1mol N2时,转移电子的物质的量为6mol |
F2是氧化性最强的非金属单质,在加热条件下,物质的量相等的F2和烧碱完全反应,生成NaF、H2O和另一种气体,该气体是下列中的()
| A.H2 | B.HF | C.O2 | D.OF2 |
根据下列反应:(1)2Fe3++2I-=2Fe2++I2(2)Br2+2Fe2+=2Br-+2Fe3+判断离子的还原性由强到弱的顺序是( )
| A.Br->Fe2+>I- | B.I->Fe2+>Br-- |
| C.Br->I->Fe2+ | D.Fe2+>I->Br- |
下列各组中的性质比较,正确的是
| A.酸性HClO4>HBrO4>HIO4 | B.碱性NaOH>Mg(OH)2>Ca(OH)2 |
| C.稳定性:HI>H2S> HCl | D.氧化性:Na+>Mg2+>Al3+ |
实验室常用NaNO2和NH4Cl反应制取N2。下列有关说法正确的是( )
| A.NaNO2是还原剂 |
| B.NH4Cl中N元素被还原 |
| C.生成1 mol N2时转移6 mol 电子 |
| D.氧化剂和还原剂的物质的量之比是1︰1 |
试题篮
()