下列反应的离子方程式正确的是 ( )
| A.Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+ CO32-+ H2O |
| B.等物质的量的Ba(OH)2与NH4HSO4在稀溶液中反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| C.向100mL 1mol/L FeBr2溶液中通入0. 5mol Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3 + 3H+=Fe3+ + 3H2O |
已知电离平衡常数:H2CO3>HClO>HCO,下列有关叙述中,正确的是
①若KI溶液中混有Br-,加入足量FeCl3溶液,用CCl4萃取后,取无色的水层并加入AgNO3溶液,有淡黄色沉淀生成。
②向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-
③向NaClO溶液中通入少量二氧化碳的离子反应方程式:2ClO-+CO2+H2O===2HClO+CO
④海水提溴过程中,用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为3 Br2+6 CO32-+3H2O="5" Br-+ BrO3-+6HCO3-
| A.②④ | B.①③ | C.②③ | D.①④ |
根据下列框图,有关说法正确的是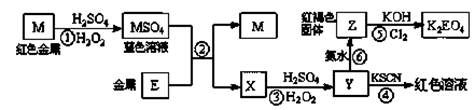
| A.M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱 |
| B.反应⑤的离子方程式可表示为:2E(OH)3 +3Cl2 +6H2O ==3EO4 2―+ 6Cl― +12H+ |
| C.反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性 |
| D.用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:EO42―+4H2O+3e-=E(OH)3+5OH― |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的离子方程式为:4FeO42-+10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
干法制备:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法错误的是
| A.高铁酸钾与水反应时,水发生氧化反应 |
| B.干法制备中,每生成1 molNa2FeO4,共转移4 mol电子 |
| C.湿法制备中,每生成1 mol Na2FeO4,,共转移3 mol电子 |
| D.K2FeO4处理水时,不仅能杀菌,还能除去等H2S、NH3,并使悬浮杂质沉降 |
今有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不氧化Fe2+和Cl-,则可加入的试剂是
| A.Cl2 | B.KMnO4 | C.HCl | D.FeCl3 |
R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z =X +Z2+ ;Y + Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合
| A.R2+>X2+>Z2+>Y2+ | B.X2+>R2+>Y2+>Z2+ |
| C.Y2+>Z2+>R2+>X2+ | D.Z2+>X2+>R2+>Y2+ |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M,关于该反应的说法中不正确的是
| A.M为H2O |
| B.SnCl62-是氧化产物 |
| C.还原性:As>SnCl2 |
| D.每生成1molAs,反应中转移电子的物质的量为3mol |
某溶液中含有的溶质是FeBr2、FeI2 ,若先向该溶液中通人一定量的氧气.再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br-一定被氧化;
②通人氮气之后原溶液中的Fe2+一定有部分或全部被氧化;
③不能确定通入氯气后的落液中是否存在;
④若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D①②③④。
在100ml含等物质的量的HBr和H2SO3的溶液中通入0.025molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。则原溶液中HBr和H2SO3的浓度都等于
| A.0.16mol/L | B.0.02mol/L |
| C.0.20mol/L | D.0.25mol/L |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是
| A.酸性(水溶液):HSCN > H2CO3 > HCN |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 |
已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。
下列结论正确的是
| A.①②③均是氧化还原反应 |
| B.反应②中氧化剂与还原剂的物质的量之比为6∶1 |
| C.氧化性强弱顺序是:K2Cr2O7>Fe2(SO4)3>I2 |
| D.反应③中0.1mol还原剂共失去电子数为1.204×1022 |
某强酸性溶液中可能存在NO-3、Cl-、I-和Fe3+中的一种或几种。向该溶液中加入溴水,单质溴被还原,由此推断该溶液中
| A.不含NO-3,可能含Fe3+ | B.含有NO-3、Cl-、I- |
| C.含I-,但不能确定是否含Cl- | D.含有Fe3+ |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M 关于该反应的说法中正确的组合是( )
① 氧化剂是H3AsO3 ② 还原性:Cl->As;③ 每生成1molAs,反应中转移电子的物质的量为3mol; ④ M为OH-; ⑤ SnCl62-是氧化产物。
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.只有①③ |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为: 3SnCl2+12Cl-+2H3AsO3+6H+===2As+3SnCl+6M,关于该反应的说法中正确的组合是:
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成7.5 g As,还原剂失去的电子为0.3 mol ④M为OH- ⑤SnCl是氧化产物
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.①③ |
试题篮
()